Westwork.id – Teori Atom merupakan salah satu konsep yang paling dasar dalam ilmu fisika dan kimia. Teori ini sudah mengalami perkembangan dan juga evolusi selama berabad-abad secara signifikan.
Dalam kehidupan kita sehari-hari, banyak sekali hal-hal di sekeliling kita yang tidak bisa dipisahkan dengan teori atom. Teori ini juga yang membuat kehidupan kita saat ini memiliki banyak sekali kemudahan.
Di artikel ini kamu bisa membaca secara rinci tentang teori atom dan konfigurasi. Disini kami juga akan membahas tentang struktur atom dan susunan elektron dalam atom.
Daftar Isi
Struktur Atom dan Konfigurasi Elektron
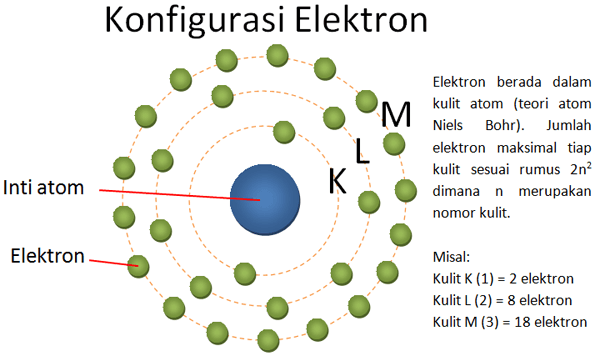
Struktur atom dan konfigurasi elektron adalah hari penting yang harus kamu pahami sebagai siswa SMA. Berikut ini adalah penjelasan secara detail tentang struktur atom dan konfigurasi elektron.
1. Struktur Atom
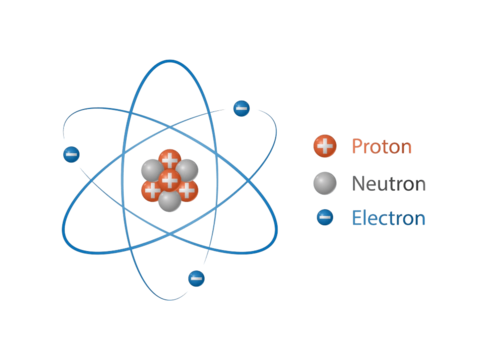
Atom merupakan unit dasar dari materi yang terdiri dari inti bermuatan positif (proton) dan juga elektron bermuatan negatif yang mengelilingi inti. Berikut ini adalah beberapa komponen kunci yang ada dalam struktur atom.
1. Proton
Proton merupakan partikel bermuatan positif yang ada di inti atom. Jumlah partikel Proton merupakan partikel yang menentukan identitas elemen kimia. Contoh, atom dengan satu Proton adalah hidrogen, dua Proton adalah helium dan seterusnya.
Muatan positif Proton seimbang dengan muatan negatif dari elektron yang mengelilingi inti, sehingga atom memiliki sifat netral secara listrik.
2. Neutron
Neutron merupakan partikel Netral yang juga terdapat di inti atom. Partikel ini membantu menjaga kestabilan dari inti atom.
Ketika ada jumlah neutron yang cukup di dalam inti atom, maka gaya nuklir antara neutron dan Proton akan mencegah proton-proton untuk saling tolak menolak yang diakibatkan oleh muatan positif mereka.
James Chadwick melakukan percobaan dengan menembaki atom menggunakan sinar alpha. Percobaan tersebut menghasilkan radiasi yang memiliki daya tembus tinggi atau tidak bermuatan dan memiliki massa 1.
3. Elektron
Elektron merupakan partikel yang bermuatan negatif yang bergerak mengelilingi inti di dalam orbital. Jumlah partikel elektron sama dengan jumlah partikel Proton di dalam atom netral.
Elektron memiliki massa yang sangat kecil bila dibandingkan dengan proton dan neutron. Distribusi orbital elektron yang berada di sekitar inti atom membentuk struktur lapisan elektron.
Struktur lapisan elektron inilah yang mempengaruhi sifat-sifat kimia pada atom. Jumlah elektron di dalam inti atom juga akan mempengaruhi sifat reaktivitas serta ikatan kimia unsur tersebut. Elektron sendiri dilambangkan dengan (simbol elektron).
2. Model Bohr Dan Model Kuantum
Model Bohr merupakan model yang menggambarkan elektron di dalam orbit tertentu yang berada di sekitar inti atom. Penjelasan tentang model ini adalah elektron mengelilingi atau layaknya planet mengelilingi matahari.
Sedangkan Model Kuantum merupakan model yang lebih akurat dan kompleks. Elektron yang berada di dalam model ini tidak memiliki lintasan pasti. Akan tetapi ada kemungkinan daerah orbital yang berada di sekitar inti.
Prinsip-prinsip dasar dalam model kuantum termasuk:
Prinsip Kepenuhan Orbital, yaitu setiap orbital dapat diisi paling banyak dua elektron dengan spin yang berlawanan.
Hukum Aufbau, yaitu elektron mengisi orbital dengan energi terendah terlebih dahulu.
Aturan Hund, yaitu ketika mengisi orbital dengan energi sama, elektron cenderung menduduki orbital dengan arah spin yang sama terlebih dahulu.
3. Konfigurasi Elektron
Konfigurasi elektron merupakan cara elektron yang diatur di dalam atom. Notasinya mengikuti urutan orbital dan prinsip-prinsip yang sudah disebutkan di atas. Contoh konfigurasi elektron untuk atom karbon (C) adalah 1s² 2s² 2p², yang artinya:
1s²: Dua elektron di orbital 1s.
2s²: Dua elektron di orbital 2s.
2p²: Empat elektron (dua pasangan) di orbital-orbital 2p.
4. Nomor Kuantum Utama
Nomor Kuantum utama (n) menggambarkan kulit tempat atau tingkat energi elektron berada. Nilai n bisa berupa bilangan bulat positif dimulai dari angka 1 dan seterusnya. Semakin tinggi nilai n semakin besar juga tingkatan energi elektron.
Nomor Atom Dan Nomor Massa

Teori Atom merupakan salah satu konsep yang paling dasar dalam ilmu fisika dan kimia. Teori ini sudah mengalami perkembangan dan juga evolusi selama berabad-abad secara signifikan.
Dalam kehidupan kita sehari-hari, banyak sekali hal-hal di sekeliling kita yang tidak bisa dipisahkan dengan teori atom. Teori ini juga yang membuat kehidupan kita saat ini memiliki banyak sekali kemudahan.
Di artikel ini kamu bisa membaca secara rinci tentang teori atom dan konfigurasi. Disini kami juga akan membahas tentang struktur atom dan susunan elektron dalam atom.
Nomor atom dan nomor massa merupakan dua konsep yang sangat penting dalam ilmu kimia. Kedua Konsep ini digunakan untuk mengidentifikasi dan juga menggambarkan unsur-unsur pada ilmu kimia.
1. Nomor Atom
Merupakan angka bulat yang digunakan untuk mengidentifikasi suatu unsur kimia. Setiap unsur kimia memiliki nomor atom yang unik dan berbeda satu sama lainnya. Nomor atom biasanya dilambangkan dengan huruf Z.
Nomor atom pada dasarnya menentukan jumlah proton yang ada dalam inti atom di unsur tersebut. Oleh karenanya, nomor atom juga bisa menentukan identitas kimia unsur itu sendiri.
Misalnya, semua atom karbon memiliki nomor atom 6 sehingga nomor atom 6 akan selalu merujuk pada unsur karbon.
Nomor atom sendiri merupakan muatan positif dalam atom. Untuk itulah, atom yang bersifat netral maka banyaknya jumlah proton sama dengan jumlah elektronnya.
2. Nomor Massa
Nomor massa merupakan jumlah proton dan neutron yang terdapat dalam inti atom. Biasanya, nomor massa akan dilambangkan dengan simbol A.
Nomor massa bisa bervariasi untuk atom-atom yang sama apabila atom-atom tersebut memiliki jumlah neutron yang berbeda. Atom-atom dengan jumlah proton yang sama namun jumlah neutron yang berbeda disebut dengan isotop.
Nomor massa digunakan untuk menghitung massa atom relatif dari suatu unsur. Maksudnya adalah unit yang digunakan untuk menyatakan massa atom relatif terhadap satu per duaan atom karbon-12 (C-12).
Isotop, Isobar, dan Isoton dalam Kimia
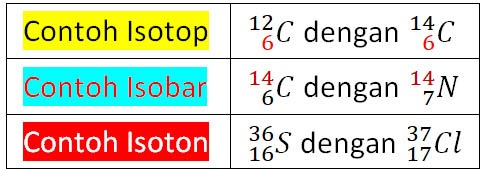
Dalam ilmu kimia, konsep isotop, isobar dan konsep isoton merujuk pada jenis hubungan berbeda antara atom-atom atau inti atom dari unsur yang berbeda pula.
Isotop melibatkan perbedaan jumlah neutron sedangkan isobar melibatkan perbedaan jumlah proton dan neutron. Di sisi lain isoton melibatkan kesamaan jumlah neutron. Berikut adalah penjelasan dari masing-masing ketiga konsep.
1. Isotop
Isotop merupakan atom-atom dari unsur yang sama dengan jumlah proton yang sama namun jumlah neutron yang berbeda karena neutron tidak memiliki muatan listrik perbedaan jumlah neutron tidak akan mempengaruhi sifat kimia tersebut.
Contoh dari isotop adalah isotop hidrogen. Hidrogen memiliki 3 isotop yang semuanya memiliki satu Proton namun jumlah neutronnya berbeda. Berikut adalah 3 isotop yang dikenal yaitu hidrogen (H-1), deuterium (H-2), dan tritium (H-3).
2. Isobar
Isobar merupakan atom-atom dari unsur-unsur yang berbeda dengan jumlah massa yang sama. Namun jumlah protonnya dan neutron yang berbeda di dalam inti atom.
Dengan kata lain, isobar memiliki nomor sayang sama namun dengan nomor atom yang berbeda. Karena perbedaan nomor atom inilah, isobar memiliki sifat kimia berbeda.
Sabar memiliki perbedaan dalam komposisi unsur yang membuatnya memiliki sifat kimia berbeda meskipun ia memiliki massa atom yang sama.
3. Isoton
Proton merupakan inti-inti atom dari unsur berbeda dengan jumlah neutron yang sama namun Ia memiliki jumlah proton berbeda di dalam inti atom. Yang artinya isoton memiliki jumlah proton bervariasi namun neutron yang identik.
Isoton memiliki sifat fisika mirip Karena jumlah neutron yang sama akan menghasilkan massa atom yang mirip. Namun sifat kimia mereka akan berbeda karena perbedaan jumlah proton menentukan sifat dari unsur kimia tersebut.
Susunan Elektron Dalam Atom
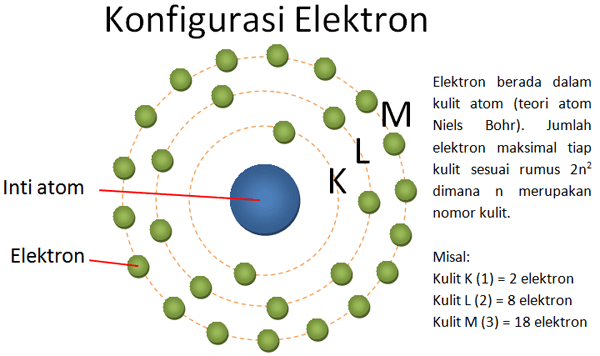
Penting untuk memiliki pemahaman tentang struktur elektron karena struktur ini mempengaruhi sifat-sifat kimia yang digunakan di teori atom. Model yang paling sering digunakan untuk menjelaskan susunan elektron adalah model kuantum.
Model Quantum menjelaskan bahwa elektron tidak bergerak dalam lintasan tetap seperti dalam Model Bohr. Namun mereka berada di dalam daerah yang disebut dengan orbital.
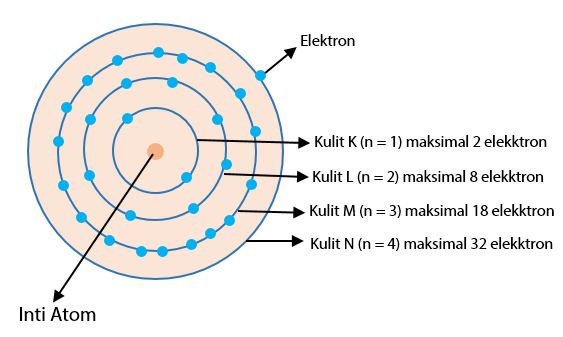
Susunan elektron dibagi menjadi beberapa kulit dan subkulit berdasarkan tingkat energi dan bentuk orbitalnya. Nomor kulit (n) yang semakin tinggi maka semakin tinggi pula energi kulit tersebut. Jumlah elektron tertinggi memenuhi rumus (rumus elektron).
Susunan dari lapisan terdekat dengan kulit sampai dengan lapisan terluar dari suatu atom adalah sebagai berikut, K, L, M, N, O, P, Q, dan selanjutnya. Berikut adalah contohnya:
Tentukan lapisan kulit P!
Jawaban: lapisan kulit P berada di urutan ke-6 sehingga n=6. Maksimum elektron dari lapisan kulit ini adalah 2.(6)²=72 elektron.
Perkembangan Teori Atom Dari Masa Ke Masa
Teori Atom merupakan salah satu konsep yang paling dasar dalam ilmu fisika dan kimia. Teori ini sudah mengalami perkembangan dan juga evolusi selama berabad-abad secara signifikan.
Dalam kehidupan kita sehari-hari, banyak sekali hal-hal di sekeliling kita yang tidak bisa dipisahkan dengan teori atom. Teori ini juga yang membuat kehidupan kita saat ini memiliki banyak sekali kemudahan.
Di artikel ini kamu bisa membaca secara rinci tentang teori atom dan konfigurasi. Disini kami juga akan membahas tentang struktur atom dan susunan elektron dalam atom.
Berikut ini adalah sejarah dan perkembangan dari teori atom yang dimulai dari zaman kuno hingga zaman modern saat ini. Mari kita jelajahi sejarah-sejarah tentang teori atom ini.
1. Teori Atom Di Zaman Kuno
Konsep awal teori atom yang muncul pada zaman kuno bermula pada abad ke-5 sebelum Masehi. Tokoh utama dari pengembangan teori atom ini adalah Leukippos serta muridnya yang bernama Demokritos.
Kedua tokoh penting ini mengembangkan ide tentang materi dan berpendapat bahwa sebuah materi bisa dibagi terus-menerus hingga materi tersebut bisa mencapai titik terkecil.
Titik terkecil ini nantinya tidak bisa dibagi lagi dan sudah menjadi sebuah zat terkecil yang disebut dengan Atomos. Kata ini berasal dari bahasa Yunani yang memiliki arti yaitu tidak dapat dibagi .
Kedua tokoh ini berpendapat bahwa atomos ini adalah unit dasar dari sebuah materi yang memiliki bentuk berbeda. Meskipun demikian pendapat ini merupakan pendapat yang lebih condong ke filosofis dibanding ilmiah.
2. Teori Atom Di Zaman Pertengahan
Pada abad pertengahan, teori kimia digunakan untuk mencari cara agar bisa mengubah logam menjadi emas. Selain itu praktek alkimia juga digunakan untuk menciptakan eliksir keabadian.
Pada zaman tersebut konsep atom tapi belum terlalu jelas karena para Alchemist masih berfokus untuk mengubah logam dibanding memahami tentang materi kimia yang mendasari perubahan logam tersebut.
Pada zaman pertengahan ini, praktek alkimia lebih banyak berkembang. Di mana praktek ini merupakan campuran dari ilmu filosofi, pengetahuan, dan juga spiritual. Tujuan dari praktek ini adalah untuk bisa mengubah materi.
3. Teori Atom Di Abad Ke-18
Pada abad ke-18 pemikiran ilmiah tentang teori atom mulai berkembang dengan lebih serius. Salah satu tokoh penting dalam perkembangan teori atom pada zaman tersebut adalah Antoine Lavoisier.
Antoine Lavoisier adalah seorang ahli kimia Prancis yang dikenal dengan hukum yang ia ciptakan. Yaitu hukum tentang kekekalan massa dan penemuannya tentang elemen kimia.
Meskipun Antoine Lavoisier tidak mengembangkan teori atom secara jelas namun Ia memiliki kontribusi yang sangat penting dalam membentuk dasar-dasar kimia di zaman modern.
4. Teori Atom Di Abad Ke-19
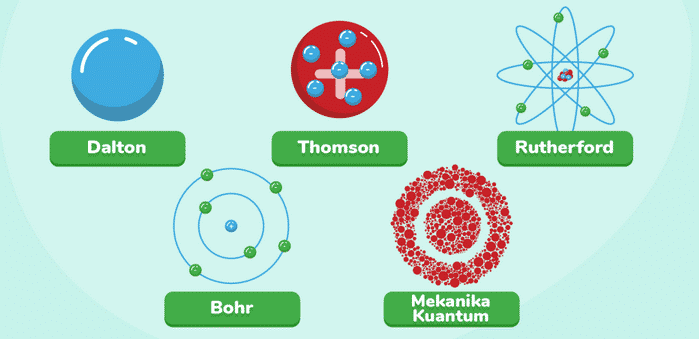
Pada abad ke-19 sejumlah ilmuwan melakukan percobaan yang bisa memberikan bukti nyata tentang keberadaan atom. Salah satu ilmuwan paling penting pada perkembangan teori atom saat itu adalah John Dalton.
Pada masa tersebut, ilmuwan lain seperti J.J. Thomson lakukan percobaan pada tabung hampa udara. Hasil percobaan tersebut membuatnya menemukan elektron di tahun 1897.
Penemuannya ini berhasil mengguncang pendapat tradisional bahwa atom adalah partikel yang tidak dapat dibagi. J.J. Thomson mengembangkan Model Plum Pudding yang menggambarkan atom sebagai bola positif.
Atom adalah bola positif dengan elektron-elektron yang tersebar di dalamnya yang diibaratkan seperti Kismis di dalam puding. Meskipun demikian, model yang dikemukakan oleh J.J. Thomson adalah langkah awal tentang struktur atom.
5. Perkembangan Teori Atom Modern Di Abad 20
Pada abad ke-20 perkembangan teori atom terlihat sangat signifikan. Salah satu ilmuwan penting dalam perkembangan teori atom ini adalah Ernest Rutherford.
Pada tahun 1909 Ia melakukan eksperimen tembakan Alfa yang mana tembakan tersebut mengarah pada penemuan inti atom. Dalam percobaan ini, yang menembakkan partikel Alfa ke lembaran emas.
Kemudian dari tembakan ini ia menyimpulkan bahwa atom harus memiliki Partikel kecil yang bermuatan positif. Atom juga harus memiliki elektron-elektron mengelilingi inti di dalam orbitnya.
Pemikiran ini berhasil menghasilkan Model Atom Rutherford. Model ini menggambarkan atom sebagai inti kecil yang memiliki muatan positif di tengah.
Namun sayangnya model ini menghadapi masalah karena berdasarkan hukum elektromagnetisme.
Yaitu elektron-elektron yang bergerak mengelilingi inti seharusnya kehilangan energi dan runtuh ke inti. Dengan model ini maka atom seharusnya runtuh dalam waktu yang singkat.
Meskipun demikian pada tahun 1913, Niels Bohr berhasil mengatasi masalah ini dengan usulan Model Atom Bohr. Di dalam model ini, ia berpendapat bahwa elektron-elektron bergerak dalam orbit tertentu.
Elektron tersebut hanya akan berpindah dari satu orbit ke orbit lainnya dengan menyerap atau melepaskan energi bentuk foton. Model ini berhasil menjelaskan spektrum atom hidrogen dan berhasil memberikan dasar pemahaman struktur atom.
Akhir Kata
Seiring berjalannya waktu teori atom mengalami perkembangan teori yang signifikan. Mulai dari pemikiran filosofis kuno hingga praktek modern berdasarkan mekanika kuantum.